Versuch I:
Anreicherung und Charakterisierung von
6-Phosphofructokinase aus Karotten
Die
6-Phosphofructokinase ist das Schlüsselenzym der Glykolyse:
6-Phosphofructokinase
Glucose
Û
Fructose-6-P ==========>
Fructose-1,6-PP -->-->
Pyruvat
ATP
-->
ADP + Pi
Durch
das Enzym wird unter ATP-Verbrauch Fructose-6-Phosphat nahezu irreversibel zu
Fructose-1,6-biphosphat phosphoryliert.
Versuch:
Anreicherung und Reinigung des Enzyms aus Karotten. Anschließend Ermittlung der Enzymaktivität und Untersuchung der Enzymkinetiken.
Teil 1: Anreicherung
und Reinigung des Enzyms
Herstellung des Rohextrakts und fraktionierte Ammoniumsulfat-Fällung (Durchführung siehe Skript):
Nach
Fällung der 6-Phosphofructokinase mit (NH4)2SO4,
welches den Proteinen die Hydrathülle entzieht und dadurch ihre Löslichkeit
erniedrigt, kann durch vorsichtiges Lösen des durch Zentrifugation gewonnenen
Niederschlags sowohl eine Anreicherung, als auch eine Reinigung erzielt werden.
100 ml Rohextrakt + 20,9 g (NH4)2SO4 (20,9 g
/ 100 ml) ==> 35 % Sättigung
¯
Zentrifugation: Rückstand 35%
(gelöst: ~
10 ml = Fraktion 1); Überstand 35%
¯
100 ml Überstand 35%
+ (NH4)2SO4
(13,5 g / 100 ml) ==>
55 % Sättigung
¯
Zentrifugation: Rückstand 55%
(gelöst: ~
10 ml = Fraktion 2); Überstand 55%
¯
116 ml Überstand 55% = Fraktion
3
¯
weitere Zentrifugation aller
Fraktionen (Abtrennung denaturierter Proteine)
Proteinbestimmung
(Durchführung siehe Skript):
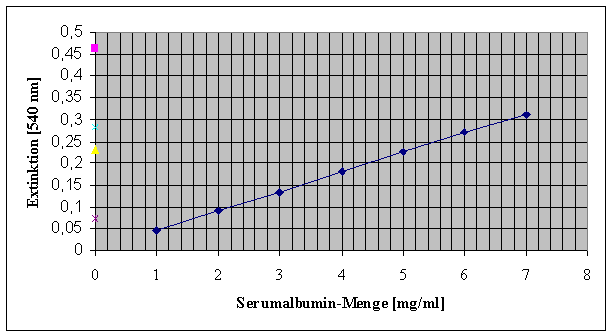
Mittels einer Serumalbumin-Eichkurve wurde der Proteingehalt im Rohextrakt und in jeder der 3 Fraktionen ermittelt. Daraus lässt sich die Protein anreicherung (bezogen auf den Rohextrakt) berechnen.
Messung der Serumalbumin-Eichkurve (1):
|
ml Serumalbumin-Lsg. / Ansatz |
0,1 |
0,2 |
0,3 |
0,4 |
0,5 |
0,6 |
0,7 |
|
==> mg Serumalbumin / ml |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
E540 |
0,0442 |
0,0906 |
0,1334 |
0,1801 |
0,2253 |
0,2725 |
0,3112 |
4 Versuchsansätze (Herstellung siehe Skript):
|
Ansatz |
Rohextrakt |
Fraktion 1 |
Fraktion 2 |
Fraktion 3 |
|
ml Fraktion |
2 |
1 |
1 |
4 |
|
ml Trichloressigsäure |
0,4 |
0,2 |
0,2 |
0,8 |
Zentrifugation der Ansätze: Rückstand in 1 ml H2O gelöst
¯
Zugabe von 5 ml Biuret-Reagenz (30 Min. stehen lassen)
¯
weitere Zentrifugation aller Ansätze (Abtrennung denaturierter Proteine)
Auswertung:
Messung der Extinktionen der verschiedenen Parallelproben (Ansätze):
|
E540 |
0,4625 |
0,2314 |
0,2838 |
0,0725 |
|
mg Protein / ml Ansatz |
10,3 |
5,2 |
6,3 |
1,6 |
|
mg Protein / ml Fraktion |
5,15 |
5,2 |
6,3 |
0,4 |
|
mg Gesamtproteinmenge |
515 |
52 |
63 |
46,4 |
|
Proteinanreicherung |
(Bezugswert) |
0,97 % |
22,3 % |
- 92,2 % |
Ergebnis:
Die meisten Proteine finden sich in Fraktion 2 (55% Sättigung) wieder.
Allerdings:
Kontrolle: 52 mg + 63 mg + 46,4 mg = 161,4 mg < 515 mg ==> ~ 68,5 % der Proteine des Rohextrakts gingen (wahrscheinlich durch
Denaturierung) verloren.
Dies kann aber auch daran gelegen haben, dass unsere zu verarbeitenden Karotten bereits sehr ausgetrocknet waren und dadurch sehr viele Proteine denaturiert vorgelegen haben könnten.
Teil 2: Bestimmung der Enzymaktivität
Die Bestimmung der Aktivität der PFK erfolgte mittels eines gekoppelten enzymatischen Tests (Reaktionen im Detail siehe Skript). Zuerst wurde in einem Kontrollversuch (Test 1) die Aktivität der Hilfsenzyme untersucht, dann die „Grundaktivität“ der NADH-Oxidase in den verschiedenen Fraktionen (Test 2). Diese muss von den Aktivitäten der Ansätze mit Fructose-6-Phosphat (Test 3) subtrahiert werden, um die tatsächliche Aktivität der PFK zu ermitteln. Grund dafür ist die Tatsache, dass bei diesen Ansätzen PFK und NADH-Oxidase nebeneinander vorliegen. Da die Aktivität der PFK proportional zum zusätzlichen NADH-Verbrauch (= Test 3 – Test 2) ist, kann eine photometrische Messung (340 nm) des NADH-Gehalts als Indikator für die enzymatisch aktive Menge an PFK dienen.
9 Versuchsansätze (Herstellung siehe Skript):
Test 1 wurde einmal (ohne Karottenextrakt) durchgeführt, Test 2 und Test 3 jedoch viermal (mit Rohextrakt und den drei Fraktionen).
Ergebnisse: (siehe Ausdrucke)
Die Abnahme der Extinktion in Test 1 beweit, dass die Hilfsenzyme arbeiten.
Die Differenz der Extinktionsabnahme (Test 3 – Test 2) zeigt, dass die PFK außer im Rohextrakt noch in Fraktion 2 aktiv vorliegt. Die Reaktion von Fraktion 2 im Test 3 verlief zunächst sehr langsam und steigerte erst nach ca. 150s. Fraktion 1 und Fraktion 3 zeigten kaum eine Reaktion. (Fraktion 1 zeigte im Test 2 einen Anstieg der Extinktion! Eine „Grundaktivität“ der NADH-Oxidase wäre also nicht vorhanden. Dies kann jedoch nicht sein, wodurch das Ergebnis von Fraktion 1 als nicht „ganz richtig“ angesehen werden konnte!)
Enzymaktivität:
V (Test): 2,5 ml
V (Einsatz): 0,2 ml
d = 1,0 cm
e340 = 6,3 x 103 l x mol-1 x cm-1
= 6,3 ml x mmol-1
x cm-1
==>
1,984127 x DE
= D
mmol
NADH / ml x min
|
Ansatz |
Rohextrakt |
Fraktion 1 |
Fraktion 2 |
Fraktion 3 |
|
DE / min |
0,066 |
0,027 (?) |
0,05 |
0,0 |
|
D mmol NADH / ml x min |
0,13095 |
0,05357 |
0,09921 |
0,0 |
|
D mmol F-6-P / ml x min |
0,06548 |
0,02679 |
0,04961 |
0,0 |
|
mkat (D mmol F-6-P / ml x sec) |
0,00109 |
0,00045 |
0,00083 |
0,0 |
|
mkat / kg Protein |
0,21165 |
0,08654 |
0,13746 |
0,0 |
|
PFK- Anreicherung |
(Bezugswert) |
- 59,1 % |
- 35,1 % |
- 100 % |
Die Proteinmenge der Fraktion 2 wurde zwar um 22,3 % erhöht, die Enzymaktivität (mkat) nahm allerdings von 0,00109 auf 0,00083 ab, d.h. die spezifische Enzymaktivität (mkat / kg) ist von 0,21165 auf 0,13746 gesunken.
Mögliche Fehlerquellen: zu starke Enzymdenaturierung?
zu alte Karotten?
Fehler bei irgendeiner Messung beim Rohextrakt?
...
Teil 3:
Enzymkinetik
Da die PFK zwei Substrate umsetzt (ATP und F-6-P), wurde sowohl die Abhängigkeit der Enzymaktivität von der ATP-Konzentration (bei konstanter F-6-P-Konzentration), als auch von der F-6-P-Konzentration (bei konstanter ATP-Konzentration) untersucht. Die charakteristischen Größen Km und Vmax wurden ausschließlich graphisch bestimmt.
Teil a: ATP-Abhängigkeit der PFK
Teil b: F-6-P-Abhängigkeit der PFK bei niedrigen ATP-Konzentrationen
Teil c: F-6-P-Abhängigkeit der PFK bei hohen ATP-Konzentrationen
Neun Versuchsansätze (Herstellung siehe Skript):
Ansätze mit variablen ATP-Konzentrationen (0,1; 0,2; 0,4; 0,6; 1; 2; 4; 6; 10 mM) bei konstanter 5 mM F-6-P-Konzentration (Teil a) zur Messung der ATP-Abhängigkeit der PFK.
|
Konz. ATP [mM] |
0,1 |
0,2 |
0,4 |
0,6 |
1 |
2 |
4 |
6 |
10 |
|
Mg.-chlorid |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
|
NADH |
0,25 |
0,25 |
0,25 |
0,25 |
0,25 |
0,25 |
0,25 |
0,25 |
0,25 |
|
F-6-P |
0,5 |
0,5 |
0,5 |
0,5 |
0,5 |
0,5 |
0,5 |
0,5 |
0,5 |
|
ATP |
0,01 |
0,02 |
0,04 |
0,06 |
0,1 |
0,2 |
0,4 |
0,6 |
1 |
|
Puffer |
1,19 |
1,18 |
1,16 |
1,14 |
1,1 |
1 |
0,8 |
0,6 |
0,2 |
|
TIM
/ GDH |
0,05 |
0,05 |
0,05 |
0,05 |
0,05 |
0,05 |
0,05 |
0,05 |
0,05 |
|
Aldolase |
0,05 |
0,05 |
0,05 |
0,05 |
0,05 |
0,05 |
0,05 |
0,05 |
0,05 |
|
Karottenextrakt |
0,05 |
0,05 |
0,05 |
0,05 |
0,05 |
0,05 |
0,05 |
0,05 |
0,05 |
Auswertung: (siehe Grafik)
Darstellung der Wertepaare f (t) = E663
==> Ermittlung der Wertepaare f ([S]) = ΔE / min
ΔE = E663 – (NADH-Oxidase (Fraktion 2) / 4
(Eigtl: NADH-Oxidase; 0,05 ml Karottenextrakt verwendet ==> ¼ von 0,2 ml vom gemessenen Wert aus Enzymaktivitäts-Versuch ==> 0,0045 )
==> 7,9365079 · ΔE = Δ mmol NADH / ml x min
==> (Δ mmol NADH / ml & min) / 2 = Δ mmol ATP / ml x min
|
Zeit [min] |
0
|
5 |
E0min-E5min
|
|
c(ATP):
0,1 mM |
0,645 |
0,625 |
0,020 |
|
c(ATP):
0,2 mM |
0,652 |
0,617 |
0,035 |
|
c(ATP):
0,4 mM |
0,603 |
0,559 |
0,044 |
|
c(ATP):
0,6 mM |
0,605 |
0,548 |
0,057 |
|
c(ATP):
1,0 mM |
0,604 |
0,552 |
0,052 |
|
c(ATP):
2,0 mM |
0,605 |
0,544 |
0,061 |
|
c(ATP):
4,0 mM |
0,612 |
0,548 |
0,064 |
|
c(ATP):
6,0 mM |
0,704 |
0,641 |
0,063 |
|
c(ATP):
10 mM |
0,618 |
0,554 |
0,064 |
|
c(ATP)
[mM] |
0,1 |
0,2 |
0,4 |
0,6 |
1,0 |
2,0 |
4,0
|
6,0 |
10 |
|
V
[mmol
ATP / ml x min] |
0,061 |
0,121 |
0,157 |
0,208 |
0,188 |
0,224 |
0,236 |
0,232 |
0,236 |
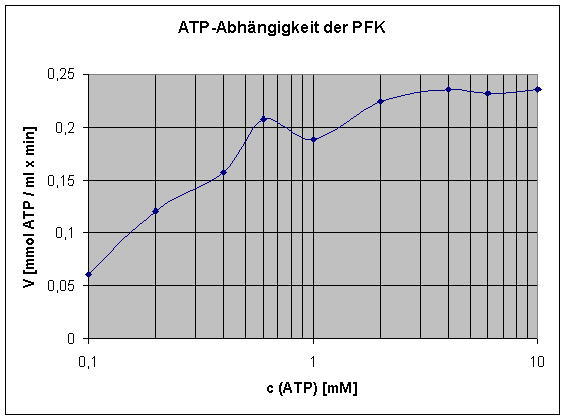
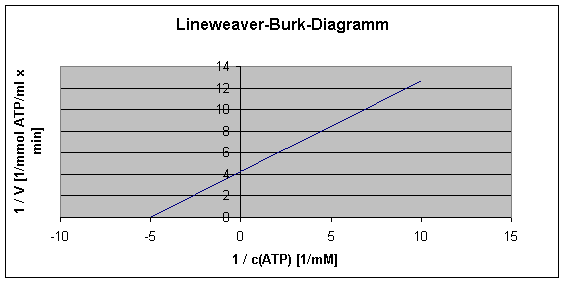
Ergebnis:
Je größer die Konzentration von ATP, umso mehr arbeitet die Phosphofructukinase, d.h. die PFK ist Substrat (ATP) induziert. Bei einer ATP-Konzentration von ca. 4,0 mM erreicht die Kurve Vmax (Vmax = 0,236) (= Sättigungsbereich). Der KM (Vmax / 2) liegt dann bei einer Substrat-Konzentration von etwa 0,2 mM. Lediglich unser Wert bei c(ATP) = 0,6 mM ist zu hoch gewesen.
F-6-P-Abhängigkeit der PFK:
|
Konz. F-6-P [mM] |
0,02 |
0,04 |
0,06 |
0,1 |
0,15 |
0,2 |
0,6 |
1 |
2 |
|
Mg.-chlorid |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
|
NADH |
0,25 |
0,25 |
0,25 |
0,25 |
0,25 |
0,25 |
0,25 |
0,25 |
0,25 |
|
F-6-P |
0,01
|
0,02 |
0,03 |
0,05 |
0,075 |
0,1 |
0,3 |
0,5 |
1 |
|
ATP |
0,1 |
0,1 |
0,1 |
0,1 |
0,1 |
0,1 |
0,1 |
0,1 |
0,1 |
|
Puffer |
1,59 |
1,58 |
1,57 |
1,55 |
1,525 |
1,5 |
1,3 |
1,1 |
0,6 |
|
TIM
/ GDH |
0,05 |
0,05 |
0,05 |
0,05 |
0,05 |
0,05 |
0,05 |
0,05 |
0,05 |
|
Aldolase |
0,05 |
0,05 |
0,05 |
0,05 |
0,05 |
0,05 |
0,05 |
0,05 |
0,05 |
|
Karottenextrakt |
0,05 |
0,05 |
0,05 |
0,05 |
0,05 |
0,05 |
0,05 |
0,05 |
0,05 |
|
Zeit [Min] |
0 |
5 |
E0min-E5min
|
|
c(F-6-P):
0,02 mM |
0,590 |
0,576 |
0,014 |
|
c(F-6-P):
0,04 mM |
0,592 |
0,572 |
0,020 |
|
c(F-6-P):
0,06 mM |
0,576 |
0,549 |
0,027 |
|
c(F-6-P):
0,10 mM |
0,574 |
0,538 |
0,036 |
|
c(F-6-P):
0,15 mM |
0,570 |
0,532 |
0,038 |
|
c(F-6-P):
0,20 mM |
0,571 |
0,530 |
0,041 |
|
c(F-6-P):
0,60 mM |
0,574 |
0,524 |
0,050 |
|
c(F-6-P):
1,00 mM |
0,572 |
0,512 |
0,060 |
|
c(F-6-P):
2,00 mM |
0,563 |
0,502 |
0,061 |
|
c(F-6-P)
[mM] |
0,02 |
0,04 |
0,06 |
0,1 |
0,15 |
0,2 |
0,6 |
1 |
2 |
|
V
[mmol
F-6-P / ml x min] |
0,038 |
0,061 |
0,089 |
0,125 |
0,133 |
0,145 |
0,180 |
0,220 |
0,223 |
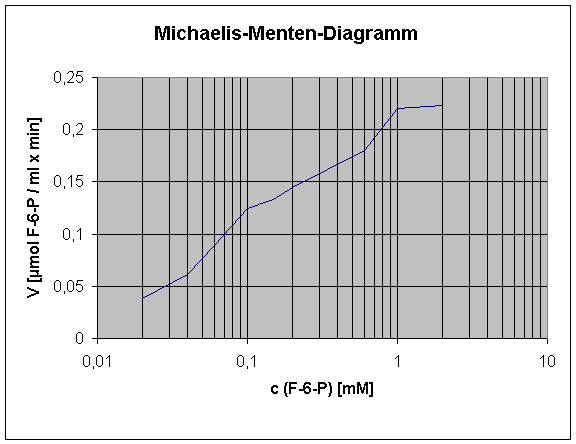
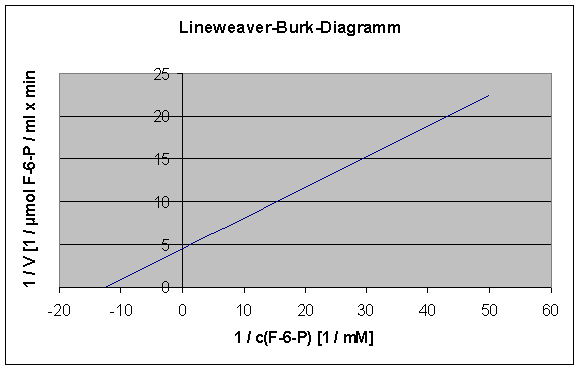
Je größer die Konzentration von F-6-P, desto mehr arbeitet die PFK. Dies ist das zweite Substrat, das eine Induzierung der PFK bewirkt. Der KM-Wert liegt bei ca. 0,08 mM. Vmax beträgt ca. 0,223 mmol / ml x min.
Messung der F-6-P-Abhängigkeit der PFK bei Hemmung
durch ATP:
Hierzu werden die gleichen Messungen durchgeführt wie bei der Messung der F-6-P-Abhängigkeit der PFK. Jedoch werden 0,6 ml ATP-Lösung eimgesetzt und die Puffermenge entsprechend reduziert.
|
Zeit [Min] |
0 |
5 |
E0min-E5min |
|
c(F-6-P):
0,02 mM |
0,575 |
0,559 |
0,016 |
|
c(F-6-P):
0,04 mM |
0,570 |
0,546 |
0,024 |
|
c(F-6-P):
0,06 mM |
0,585 |
0,556 |
0,029 |
|
c(F-6-P):
0,10 mM |
0,580 |
0,542 |
0,038 |
|
c(F-6-P):
0,15 mM |
0,585 |
0,539 |
0,046 |
|
c(F-6-P):
0,20 mM |
0,572 |
0,526 |
0,046 |
|
c(F-6-P):
0,60 mM |
0,575 |
0,511 |
0,064 |
|
c(F-6-P):
1,00 mM |
0,581 |
0,517 |
0,064 |
|
c(F-6-P):
2,00 mM |
0,595 |
0,523 |
0,072 |
|
c(F-6-P)
[mM] |
0,02 |
0,04 |
0,06 |
0,1 |
0,15 |
0,2 |
0,6 |
1 |
2 |
|
V
[mmol
F-6-P / ml x min] |
0,045 |
0,077 |
0,097 |
0,133 |
0,165 |
0,165 |
0,236 |
0,236 |
0,268 |
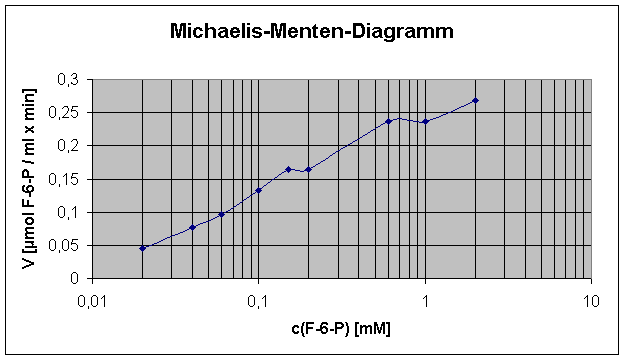
0,6 ml ATP-Lösung haben keine Hemmung der PFK bewirkt. Anscheinend hat die Menge an ATP-Lösung nicht ausgereicht, um die zu erwartende allosterische Hemmung auszulösen.