Versuch 10: Photosynthese und Atmung
Versuch
X A: Messung der Hill-Reaktion mit isolierten Chloroplasten
Nach
HILL können isolierte Chloroplasten unter Zugabe von künstlichen
Elektronen-akzeptoren Sauerstoff entwickeln. Diese Beobachtung sollte
photometrisch an osmotisch aufgebrochenen Chloroplasten nachgewiesen werden.
20
g Erbsensprosse wurden in Isolationsmedium im Mixer homogenisiert. Durch den
Zusatz von Saccharose wurde das vorzeitige Aufplatzen der Chloroplasten
verhindert, wodurch die Isolation der Thylakoide erschwert würde. Nach
Filtrierung des Homogenats durch ein Nylontuch wurde zentrifugiert und der Überstand
(Chloroplastenbruchstücke) verworfen.
Das
Pellet wurde in Isolationsmedium resuspendiert und erneut zentrifugiert. Die im
Niederschlag nun vorhandenen Chloroplasten wurden mittels Lysemedium osmotisch
aufgebrochen, 5 min auf Eis gestellt und zentrifugiert. Der Niederschlag wurde
in Inkubationsmedium aufgenommen.
Um
den Erfolg der Lyse festzustellen, wurden intakte und aufgebrochene
Chloroplasten mikroskopisch untersucht.
Intakte
Chloroplasten:
Aufgebrochene
Chloroplasten:
Es
war nur eine geringe Deformierung zu sehen. Die Vergrößerung (40x) war zu
klein um Details zu erkennen.
Es
wurden nun in vier Reagenzgläser Inkubationsmedium und DCPIP-Lösung pipettiert
und auf 25°C erwärmt. Dann wurden die Gläser folgendermaßen beschickt bzw.
präpariert:
|
Nr.
1 |
Nr.
2 |
Nr.
3 (mit Alufolie lichtdicht umhüllt) |
Nr.
4 |
|
aufgebrochene
Chloroplasten |
2
min erhitzte, aufgebrochene Chloroplasten |
aufgebrochene
Chloroplasten |
aufgebrochene
Chloroplasten +
Na2S2O4 |
Dann
wurde die Hill-Reaktion durch Einschalten des Dia-Projektors gestartet. Nach 10,
20 bzw. 30 min wurden Proben entnommen, zentrifugiert und gegen die Probe Nr. 4
(entspricht dem Nullwert) im Photometer bei 600 nm gemessen.
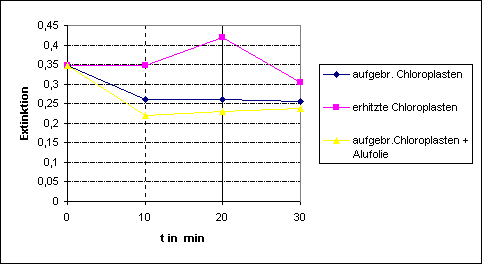
Die
Extinktionen sind in der Tabelle dargestellt:
|
Zeit
in min |
Nr.
1 |
Nr.
2 |
Nr.
3 |
|
10 |
0,260 |
0,349 |
0,220 |
|
20 |
0,261 |
0,420 |
0,230 |
|
30 |
0,255 |
0,303 |
0,237 |
Die Hill-Reagenz ersetzte die natürlichen Elektronenakzeptoren NADH und Plastocyanin, die durch das Aufbrechen der Chloroplasten entfernt wurden. Das Entfärben der blauen DCPIP-Lösung beruht darauf, dass Sauerstoff gebildet werden konnte, der die Lösung reduzierte.
Nr.
1:
Es
kommt zu einer Senkung der Extinktion, was auf die Aktivität der Thylakoide
hinweist. In den ersten 10 min ist ein steilerer Abfall zu erkennen, während
danach die Extinktion langsamer abnimmt. Evtl lag die verminderte Aktivität der
Thylakoide an einer Sättigung.
Nr.
2:
Es
kam kaum zu einer Senkung der Extinktion. Der zweite Meßwert ist als falsch
einzustufen, da eine Zunahme der Extinktion keinen Sinn macht. Der leichte
Abfall kann auf den im Medium gelösten Sauerstoff zurückzuführen sein oder
auf teilweise Denaturierung.
Nr.
3:
Die
Enzyme hätten in diesem Fall auf Grund des Lichtmangels nicht aktiv sein dürfen.
Wahrscheinlich ist der Abfall dadurch zu erklären, dass nicht schnell genug
abgedunkelt wurde, da ja dann der Wert relativ konstant blieb. Dennoch ist die
Extinktionsabnahme fälschlicherweise größer als bei Nr. 1.
Nr.
4:
Die
Lösung wurde durch die Zugabe von Natriumdithionit sofort entfärbt, da die
Hill-Reagenz reduziert wurde. Die Probe konnte deshalb als 0-Probe verwendet
werden.
Für
die Chlorophyllbestimmung wurde eine Probe mit aufgebrochenen Chloroplasten wie
Nr. 1 angesetzt. Es wurden zweimal 1,5 ml in Eppendorf-Gefäße pipettiert,
zentrifugiert und das Pellet mit Aceton aufgenommen. Die Proben wurden dann 15
min im Dunklen stehen gelassen. Nach erneuter Zentrifugation wurden sie auf 2 ml
mit Aceton aufgefüllt. Die Extinktion wurde im Photometer bei 645 nm
(Chlorophyll b) und 663 nm (Chlorophyll a) gegen Aceton gemessen:
|
|
Probe
1 |
Probe
2 |
|
645
nm |
0,028 |
0,034 |
|
663
nm |
0,032 |
0,035 |
Enpirische
Formel für die Berechnung der Chlorophyllkonzentration:
mg Chlorophyll/ Liter = E645 x 20,2 + E663
x 8,02
Chlorophyllkonzentration
Probe 1= 0,028 x 20,2 + 0,032 x 8,02 = 0,822 mg /Liter
Chlorophyllkonzentration
Probe 2= 0,034 x 20,2 + 0,035 x 8,02 = 0,968 mg /Liter
Mittelwert:
0,895 mg/Liter
Berechnung
der Menge im Reagenzglas:
Acetonextrakt:
1,79 x 10-3 mg/ml
1,79 x 10-3 mg/2ml x 12,7ml/1,5 =
0,015 mg/Reagenzglas
Mit
Hilfe des Lambert-Beerschen Gesetzes kann die Menge des verbrauchten DCPIP
berechnet werden:
|
Nr. |
1 |
2 |
3 |
4 |
|
D E |
0,094 |
0,046 |
0,112 |
0 |
|
µmol DCPIP/(ml x min) |
0,0046 |
0,0023 |
0,0055 |
0 |
|
µmol DCPIP /(ml x h) |
0,276 |
0,138 |
0,33 |
0 |
|
µmol DCPIP/ |
308,4 |
154,2 |
368,7 |
0 |
Ist das Photosystem II voll funktionsfähig, werden pro Stunde also 308,4 µmol DCPIP pro mg Chlorophyll reduziert.
B:
Spektroskopie der Cytochrome in vivo
Reduzierter
und oxidierter Zustand der Cytochrome lassen sich auf Grund der verschiedenen
Absorptionsmaxima unterscheiden.
Eine
20%ige Hefesuspension mit Glucosezusatz wurde etwa 1 h mit kräftigem Luftstrom
geperlt. Dabei wird die Hefe zur Atmung angeregt. Nach Unterbrechung der
Sauerstoffzufuhr werden Elektronen auf die Cytochrome übertragen, die dadurch
reduziert werden.
Die
Küvette wurde nun mit einem Projektor durchleuchtet. Die Suspension erscheint
dabei rötlich, was auf Absorption im Blauen beruht. Mit einem Handspektroskop
sind zwei dunkle Banden im grünen und gelben Bereich zu erkennen.
Durch
Zugabe von 3%igem H2O2 wurden die Cytochrome oxidiert;
daraus resultierte ein helleres Spektrum, da die Absorption insgesamt geringer
wurde, und die Banden erschienen weniger dunkel.
_____________________________
Versuch 10: Photosynthese und Atmung
A: Messung der Hill-Reaktion mit Isolierten
Chloroplasten
Durchführung
Extraktion:
Erbsenprosse werden in Isotonischem Puffer zerkleinert und abfiltriert. Das Filtrat wird differentiell zentrifugiert, so dass die intakten Chloroplasten im Pellet sind. Die isolierten Chloroplasten werden mikroskopiert und mit hypotonischem Medium osmotisch aufgebrochen. Die aufgebrochenen Chloroplasten werden erneut angereichert und Mikroskopiert.
Hill-Reaktion:
4 Verschiedene Proben mit DCPIP und Inkubationsmedium werden wie folgt angesetzt.
1: Chloroplasten
2: erhitzte Chloroplasten
3: Chloroplasten, abgedunkelt
4: Chloroplasten und Na2S204
Alle Ansätze werden beleuchtet, und alle 10 Min. werden Proben entnommen, zentrifugiert und der Überstand Photometrisch gemessen. DCPIP ist ein blauer Farbstoff, der in reduziertem Zustand farblos ist.
Chlorophyllbestimmung
Aufgebrochene Chloroplasten werden angereichert, und mit Aceton versetzt, wodurch Chlorophyll extrahiert wird. Nach 15 min wird erneut zentrifugiert und das Pellet mit Aceton gelöst. Jetzt kann man das gelöste Chlorophyll quantitativ im Photometer (645nm und 663nm) bestimmen.
Ergebnis
Mikroskopie
Isolierte Intakte Chloroplasten Aufgebrochene Chloroplasten
Hill-Reaktion
Die Tabelle zeigt die Extinktionen der verschiedenen Proben bei 600 nm. Als Nullwert wurde Probe 4 verwendet.
|
Zeitpunkt |
Probe 1 |
Probe 2 |
Probe 3 |
Probe 4 |
|
0 |
0,822 |
0,841 |
0,851 |
0 |
|
10` |
0,659 |
0,851 |
0,863 |
0 |
|
20` |
0,552 |
0,837 |
0,867 |
0 |
Die Berechnung des DCIP-Verbrauches ist im Prinzip nur für Probe 1 Sinnvoll (Probe 4 als Vergleichswert), da die Extinktion bei den anderen Proben stieg oder gleich blieb. Extinktionsdifferenz ermittelt aus den Werten bei 0 min und 10 min:
E1
= 0,0163/min
E4 = 0,0
/min
Verbrauch an DCPIP pro ml und min:
Probe 1 =
0,049 µmol
Probe 4 = 0,0 µmol
Chlorophyllbestimmung
Extinktion bei 645 nm: 0,045
Extinktion bei 636 nm: 0,041
mg
Chlorophyll/Liter = (E * 20,2
+ E * 8,02) = 1,1689 mg/l
Chlorophyllmenge im Aceton: 1,17 : 1000 ml = x : 2,0 ml x = 2,3*10-3 mg
Chlorophyllmenge im Reagenzglas: 1,5 ml : 2,3*10-3 mg = 12,7 ml : x x = 0,0198 mg
Diskussion
Mikroskopie
Wie zu erwarten zeigten sich in der ersten Mikroskopie runde Chloroplasten und einige andere Zellbestandteile, in der zweiten waren unregelmäßige Gebilde zu erkennen.
Hill-Reaktion
Die einzige Probe, in der eine Entfärbungsreaktion stattfinden sollte, ist Probe 1. Das Ergebnis entsprach dieser Erwartung, allerdings nimmt die Extinktion bei den anderen Proben zu, was nur auf einen Eichungsfehler zurückzuführen ist. Die Berechnung des DCPIP-Verbrauches ist deshalb vermutlich etwas zu hoch.
Jedenfalls konnte der wichtigste Punkt gezeigt werden, nicht erhitzte Thylakoide können in Gegenwart von DCPIP funktionieren, und Elektronen auf Reduktionsäquivalente übertragen.
In der abgedunkelten Probe konnte keine Reaktion stattfinden, da diese Licht benötigt, und in der Probe 4 wurde alles DCPIP durch Na2S204 reduziert, weswegen sie völlig entfärbt war und als Refernzwert dienen konnte.
B: Spektroskopie der Cytochrome in vivo
Durchführung
Eine Hefesuspension wurde 1h lang mit 02 und Zucker zur aeroben Atmung gebracht. Die Suspension sollte dann mit dem Handspektroskop vor und nach der Behandlung mit Wasserstoffperoxyd betrachtet werden.
Da die Eichung des Gerätes aber schwierig und ungenau ist, versuchten wir, die Unterschiede der Absorption anhand eines Absorptionsspektrums zu zeigen, wobei der Referenzwert die oxidierte Suspension wäre und der Messwert die nicht oxidierte. Offensichtlich sind aber zu viele andere Substanzen in der Suspension vorhanden, welche ein solches Spektrum bis zur Unkenntlichkeit verzerren.
Ergebnis/Diskussion
Die Suspension wurde nach Oxidation heller, Absorptionsbanden konnten mit dem Handspektroskop nur undeutlich erkannt werden. (Etwas dunklere Banden bei der reduzierten Form).