Versuch 8: Biopolymere III und Biochemie II
Ohne
ihre spezifischen Strukturen verlieren Proteine ihre biologische Aktivität.
Ziel des Versuchs ist es, die Einwirkung von Hitze, Schwermetall und konz. Salzsäure
auf Proteine zu untersuchen. Außerdem soll der Proteingehalt der Kartoffel
quantitativ bestimmt werden.
50
g Kartoffel wurde geschält, zerkleinert und im Mixer mit Tris/HCl
homogenisiert. Der Saft wurde durch ein Leintuch gepresst und anschließend 5
min zentrifugiert.
Je
2 ml des Überstands wurden dann folgendermaßen behandelt:
1. Hitzefällung:
5 min erhitzen im kochenden Wasserbad
2. Schwermetallfällung: Zugabe von 10%igem Zinkacetat
3. Ammoniumsulfatfällung: Zugabe von 2,4 ml Ammoniumsulfatlösung
Der
bei allen Reaktionen entstandene Niederschlag wurde nun abzentrifugiert und der
Überstand verworfen. Beim Versuch, die Sedimente wieder mit Puffer zu lösen,
zeigte sich, dass nur die Ammoniumsulfatfällung reversibel ist.
Erklärung:
1. Durch
die Hitze wird die Tertiär- und Quartärstruktur zerstört
=> irreversible Denaturierung
2. Zink lagert sich ein und zerstört dadurch die H-Brückenbindungen
=> irreversible Denaturierung
3. Ammoniumsulfat
entzieht die Wasserhülle
=>lässt sich durch Puffer wieder regenerieren,
reversibler Vorgang
Zur
Bestimmung der Proteinkonzentration wurde eine Eichkurve aufgestellt. Dazu
pipettierte man verschiedene Mengen einer Serumalbumin-Lösung (5 mg/ml) in ein
Reagenzglas, füllte auf 1 ml auf
und gab 4 ml Biuret-Reagenz dazu. Diese enthält Kupferionen, die mit den
CO-NH-Gruppierungen einen violetten Komplex ergeben. Mit verschiedenen
Mengen einer 1:2 Verdünnung des Preßsafts wurde genauso verfahren. Die
Ansätze wurden 30 min bei Raumtemperatur inkubiert. Anschließend wurde die
Extinktion der Proben bei 540 nm gemessen.
|
ml
Albumin |
0 |
0,1 |
0,2 |
0,4 |
0,6 |
1,0 |
|
Extinktion |
0,225 |
0,474 |
0,530 |
Werte
verfälscht wg. zu hoher Konz. |
||
Eichkurve
(fett gedruckt):
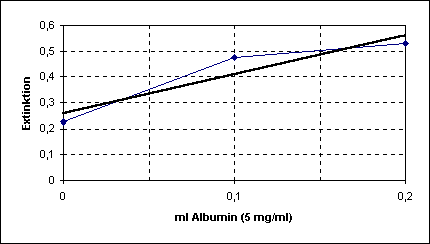
|
ml
verd. Preßsaft |
0,25 |
0,5 |
1,0 |
|
Extinktion |
0,310 |
0,401 |
verfälscht
(s.o.) |
|
|
|||
|
entspricht
ml Albuminlösung |
0,025 |
0,1 |
- |
|
entspricht
mg Albumin |
0,125 |
0,5 |
- |
Die
Verdünnung einberechnet und auf 1 ml hochgerechnet ergeben sich folgende Werte:
|
mg
Protein/ml |
1,0 |
2,0 |
|
Mittlerer
Proteingehalt mg/ml |
1,5 |
|
Da
das gesamte Überstandsvolumen des Preßsafts nicht gemessen wurde, kann der
prozentuale Proteingehalt des Kartoffelgewebes (Erfahrungswert ca. 2%) nicht
berechnet werden.
Versuch VIII B: Nachweis der Succinat-Dehydrogenase im Rohextrakt
keimender Sonnenblumen-Samen
Im
Citronensäurezyklus wird der Wasserstoff von Succinat durch die
Succinat-Dehydrogenase auf FAD übertragen. Er kann aber auch auf einen
Redoxfarbstoff wie das blaue 2,6-Dichlor-phenolindophenol übertragen werden,
das im reduzierten Zustand farblos ist.
5
g von drei Tage alten Sonnenblumenkeimlingen wurden mit Phosphatpuffer auf Eis
zerrieben. Das Homogenat wurde durch ein Nylontuch gepresst und durch
Zentrifugation grobe Partikel entfernt. Thunbergröhrchen wurden wie im Skript
angegeben beschickt, d. h. mit Wasser, Puffer, Farbstoff, Succinat und
Sonnenblumenextrakt, wobei einmal das Succinat weggelassen wurde und einmal
gekochter Sonnenblumenextrakt zugegeben wurde. Es wurde auch noch eine
Parallelprobe angesetzt, die sich aber im Ergebnis nicht unterschied. Noch vor
Einmischen des Extrakts wurde außerdem evakuiert, um zu verhindern, dass
Sauerstoff in die Atmungskette geschleust und sie dadurch blockiert wird. Dann
wurden die Röhrchen gekippt und in ein 32°C Wasserbad gestellt.
Im
Idealfall hätten sich nach einiger Zeit die Röhrchen mit ungekochtem Extrakt
und Succinat entfärben sollen, da der Farbstoff reduziert wird. Bei den anderen
Ansätzen hätte es keine sichtbare Reaktion geben dürfen, da in einem Fall das
Enzym durch die Hitze denaturiert wurde und im anderen Fall kein Substrat für
das Enzym vorhanden war (eine ganz leichte Entfärbung wäre hier durch
endogenes Substrat zu erklären). Somit wäre gezeigt, dass die Entfärbung auf
die Wirkung der Succinat-Dehydrogenase zurückzuführen ist.
Dieser
Nachweis konnte nicht erbracht werden, da die Evakuierung an der
Wasserstrahlpumpe fehlschlug und Wasser in die Thunberg-Röhrchen gelangte. Die
Entfärbungsintensität konnte so auf Grund der Verdünnung nicht mehr eindeutig
bestimmt werden; wenn überhaupt war nur eine geringe Entfärbung des vollständigen
Ansatzes erkennbar. Wahrscheinlich wurde die Reaktion auch durch den zu hohen
Sauerstoffpartialdruck behindert.
_______________________________________________________________
Versuch 8: Biopolymere III und Biochemie II
A: Isolierung und Quantitative Bestimmung von Protein
aus Kartoffelknollen
Durchführung
Protein-Fällung
Aus Gemixten Kartoffeln wurde der Saft ausgepresst, und die darin gelösten Proteine durch verschiedene Verfahren ausgefällt.
- Probe 1: Fällung durch Hitze (5 min. Wasserbad)
- Probe 2: Fällung durch Schwermetallionen (Zinkacetat)
- Probe 3: Fällung durch Ammoniumsulfat
Quantitative Proteinbestimmung:
Es wurde eine Eichgerade mit 6 bekannten Konzentrationen eines Proteins (Serumalbumin) hergestellt. Die Eichproben wurden mit Biuret „angefärbt“ (Kupferionen) und die Extinktion der jeweiligen Konzentrationen mittels Photometer ermittelt.
Anschließend wurde der zu untersuchende Kartoffelsaft auf verschiedene Konzentrationen verdünnt und ebenfalls mit Biuret-Lösung versetzt. Nach 30 min. wurde die Extinktion gemessen.
Ergebnis
Protein-Fällung
- Probe 1: Der Niederschlag ist flockig und lässt sich nicht mit Puffer lösen
- Probe 2: Der Niederschlag ist etwas feiner und lässt sich ebenfalls nicht lösen
- Probe 3: Der Niederschlag lässt sich leicht lösen.
Quantitative Proteinbestimmung
1. Extinktionswerte der Eichproben mit Serumalbumin
Anlage 1. zeigt die Werte aus Tabelle 1 und 2 Graphisch dargestellt
|
Konzentration in ml/ml |
0,0 |
0,1 |
0,2 |
0,4 |
0,6 |
1,0 |
|
Reihe 1 |
0,057 |
0,068 |
0,078 |
0,091 |
0,141 |
0,297 |
|
Reihe 2 |
0,059 |
0,066 |
0,079 |
0,092 |
0,143 |
0,368 |
|
Mittelwert |
0,058 |
0,067 |
0,078 |
0,092 |
0,142 |
0,332 |
2. Extinktionswerte der Testproben aus Kartoffelsaft
|
Konzentration in ml /ml |
0,25 |
0,5 |
1,0 |
|
Probe 1 |
0,14 |
0,163 |
0,208 |
|
Probe 2 |
0,113 |
0,167 |
0,233 |
Damit ergeben sich folgende Konzentrationen:
0,25 ml einer 1:2 Verdünnung entsprechen (laut Eichgeraden) 0,525 bzw. 0,61 ml Serumalbumin (5 mg/ml)
- 0,525 *5 * 3 = 7,87 mg Protein in 0,25 ml Kartoffelsaft
- 0,61 *5*3 = 9,15 mg Protein in 0,25 ml Kartoffelsaft
0,5 ml einer 1:2 Verdünnung entsprechen 0,68 ml Serumalbumin
- 0,68*5*3 = 10,2 mg Protein in 0,5 ml Kartoffelsaft
1,0 ml entsprechen 0,8 bzw 0,85 ml Serumalbumin
- 0,8*5*3 = 12 mg Protein in 1 ml Kartoffelsaft
- 0,85*5*3 = 12,75 mg Protein in 1 ml Kartoffelsaft
|
Ml Kartoffelsaft |
0,25 |
0,5 |
1,0 |
|
Mg Protein I |
9,15 |
10,2 |
12,75 |
|
Mg Protein II |
7,87 |
10,2 |
12 |
|
Auf 1 ml gerechnet |
36,6 |
20,4 |
12,75 |
|
Auf 1 ml gerechnet |
31,48 |
20,4 |
12 |
Durchschnittlich sind im Kartoffelsaft 22 mg Protein/ml
Diskussion
Proteinfällung
Da die Proteine durch Hitze und Schwermetallionen irreversibel denaturiert werden, können sie auch nach Entfernen des Fällungsmittels nicht mehr in Lösung gebracht werden. Die genannten Mittel brechen kovalente Bindungen auf bzw. bilden unlösliche Komplexe mit den Proteinen.
Ammoniumacetat dagegen entzieht den gelösten Proteinen lediglich die Hydrathülle und fällt sie somit aus, ohne sie irreversibel zu denaturieren. Deshalb lässt sich diese Probe nach entfernen des Ammoniums ohne weiteres wieder lösen.
Quantitative Proteinbestimmung
Die Werte für die verschiedenen Konzentrationen des Saftes fallen recht unterschiedlich aus. Dies liegt vermutlich an einer Unregelmäßigkeit bei der Eichgeraden, möglicherweise ein Pipettierfehler.
B: Nachweis der Succinat-Dehydrogenase im Rohextrakt
keimender Sonnenblumen-Samen
Durchführung
Sonnenblumenkeimlinge werden bei pH7 zerkleinert, ausgepresst und abzentrifugiert. Der Überstand wird in 6 Thunberg-Röhrchen verteilt und mit 2,6-Dichlorhenolindophenol und Succinat versetzt.
Der Farbstoff kann von Succinat-Dehydrogenase aus dem Zitronensäurezyklus unter (möglichst) anaeroben Bedingungen reduziert werden und ist dann farblos.
In zwei Proben wurde der Sonnenblumenextrakt abgekocht, in zwei weiteren wurde kein Succinat zugegeben.
Nun werden die Röhrchen evakuiert, damit der O2-Partialdruck sinkt, und der Farbstoff nicht zurückoxidiert wird. (auch Succinat und Enzym werden leicht oxidiert). In unserem Fall war das Evakuieren etwas problematisch, da die Pumpe nicht richtig funktionierte und dadurch eine Probe vernichtet wurde und neu angesetzt werden musste.
Ergebnis
|
Probe |
1 |
2 |
3 |
4 |
5 |
6 |
|
Be- schickung |
Succinat Extrakt |
Succinat Extrakt |
Extrakt |
Extrakt |
Succinat Extrakt gekocht |
Succinat Extrakt gekocht |
|
Entfärbung |
Komplett |
Komplett |
Etwas |
Etwas |
Nicht |
Nicht |
Diskussion
Probe 5 +6 weisen nach, dass es sich bei den Molekülen, die die Reaktion bewerkstelligen um Proteine handelt. Wie im Versuch A schon gezeigt, denaturiert Hitze die Proteine, und ohne sie läuft keine Reaktion mehr ab.
Mit den Proben 3 + 4 zeigt man, dass es sich bei dem Substrat für das Enzym um Succinat handeln muss. Die Reaktion läuft ohne zusätzliches Succinat wesentlich schwächer ab. Dass überhaupt eine Reaktion zustande kommt liegt daran, dass sich auch noch Succinat in dem Zellextrakt befindet.
Bei Probe 1+2 funktioniert die Reaktion erwartungsgemäß.