Versuch III: Transportprozesse, Wasserhaushalt II
Versuch III A, B, C
Versuch
III, A: Messung der Transpiration im Potometer
Mit
dem folgenden Versuch soll die Transpiration einer Pflanze bei unterschiedlichen
Bedingungen gemessen werden.
Ein
Stengel von Cyperus alternifolius wird
unter Wasser abegschnitten und ohne Lufteinschlüsse in einem Pototmeter
verankert. An Hand der Bewegung der Luftblase in der wassergefüllten Kapillare
kann die Geschwindigkeit der Wasseraufnahme abgelesen werden. Die zurückgelegte
Strecke wird alle zwei Minuten gemessen; einmal bei Windstille, dann bei
leichtem und starkem Wind.
Die Windmessung erfolgt mit einem
Schalenkreuz-Windmesser. Die relative Luftfeuchtigkeit wird mit einem
Assmann-Aspirationspsychometer gemessen und mit Hilfe des im Skript angeführten
Diagramms ermittelt.
Die
relative Luftfeuchtigkeit betrug in allen Messreihen 53% (trockenes Thermometer
21°C, feuchtes Thermometer 15°C), die Lufttemperatur 21°C.
Windstärke
0 m/s.
|
t
[min] |
0 |
2 |
4 |
6 |
8 |
10 |
12 |
14 |
16 |
18 |
20 |
|
s
[cm] |
0 |
0,4 |
0,7 |
0,9 |
1,3 |
1,7 |
2,0 |
2,3 |
2,6 |
3,0 |
3,3 |
Windstärke
5,5 m/s:
|
t
[min] |
0 |
2 |
4 |
6 |
8 |
10 |
12 |
14 |
16 |
18 |
20 |
|
s
[cm] |
0 |
0,4 |
0,9 |
1,3 |
1,6 |
1,9 |
2,2 |
2,5 |
2,8 |
3,1 |
3,4 |
Windstärke
8 m/s:
|
t
[min] |
0 |
2 |
4 |
6 |
8 |
10 |
12 |
14 |
16 |
18 |
20 |
|
s
[cm] |
0 |
0,8 |
1,2 |
1,5 |
1,8 |
2,2 |
2,9 |
3,2 |
3,6 |
3,9 |
4,2 |
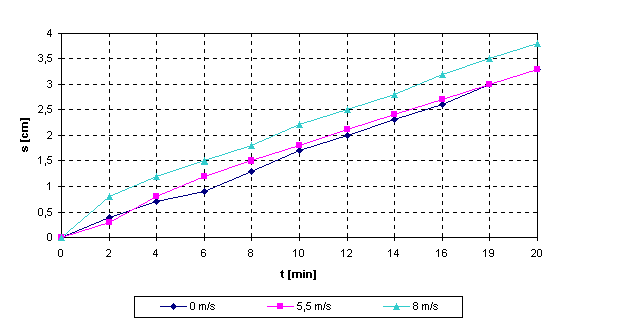
Die
Transpiration nahm mit steigender Luftbewegung zu. Normalerweise schliessen sich
die Stomata bei stärkerem Wind, so dass der Austrocknung durch physikalische
Einflüsse entgegengewirkt wird. Da es keine logische Erklärung für die hohe
Transpiration im Falle des Starkwindes gibt, kann ein Messfehler nicht
ausgeschlossen werden. Der Vergleich der Transpiration bei Windstille und
leichtem Wind zeigt, dass hier die physikalische Komponente Wind eine Rolle
spielt, solange er nicht so stark ist, dass sich die Stomata zum Schutz
schliessen. Die beschleunigte Transpiration bei leichtem Wind ist dadurch zu
erklären, dass Dampfhauben auf der Blattoberfläche weggeblasen werden und so
mehr Wasser entzogen wird.
Die
Geschwindigkeit des Wassertransports wurde noch auf eine zweit Weise untersucht.
Weiße Blüten wurden in ein Gefäß mit 10%iger, saurer Fuchsinlösung gestellt. Nach einiger Zeit kann man die Rotfärbung der Blattadern verfolgen. Der Farbstoff gelangte in etwa 30 min 8,9 cm (vom Stil bis zum Blütenrand). Daraus lässt sich eine Transportgeschwindigkeit von ca. 0,05 mm/sec ermitteln.
Versuch
III B: Selektive Ionenaufnahme
Zellen
können Ionen sowohl durch Diffusion als auch durch aktiven,
energieverbrauchenden Transport aufnehmen. Die Ionenaufnahme macht sich in einem
veränderten pH-Wert bemerkbar, da die Elektroneutralität gewahrt werden muss.
Werden bevorzugt Anionen aufgenommen wird das Medium basischer; und saurer bei
Kationenaufnahme.
Die
für den Transport benötigte Energie in Form von ATP wird aus Stärke bzw.
Glucose gewonnen. Bietet man einer stärkeverarmten oder -freien Alge Glucose
und kann durch deren Veratmung ein höherer Transport erfolgen als bei Zellen
ohne Glucose, so ist dies ein Hinweis auf aktiven Transport.
In
zwei 100 ml Enghals-Erlenmeyerkolben wurden jeweils 6 ml einer Algensuspension
von Chlorella vulgaris gegeben. Dazu
wurde jeweils 2 ml 2%ige (G/G) NH4Cl pipettiert und nur zu einer
Suspension 2 ml 2%ige Glucoselösung. Dann wurde mit Wasser auf 16 ml aufgefüllt.
Die Endkonzentration jeder zugesetzten Substanz sollte nun 0,25% (G/G) betragen.
Mittels
0,02 N HCl bzw. NaOH wurden mit dem vorher geeichten pH-Meter die Proben auf
einen pH von 5,0 (±0,2) eingestellt.
Die
Suspensionen wurden auf einen Schüttler gestellt und im Abstand von 30 min wurde der pH-Wert mit der
Glaselektrode gemessen.
|
t
in min |
pH
ohne Glucose |
pH
mit Glucose |
|
0 |
5,0 |
5,0 |
|
30 |
5,19 |
5,40 |
|
60 |
5,25 |
5,08 |
|
90 |
4,93 |
4,41 |
|
120 |
5,02 |
3,80 |
|
150 |
4,85 |
3,54 |
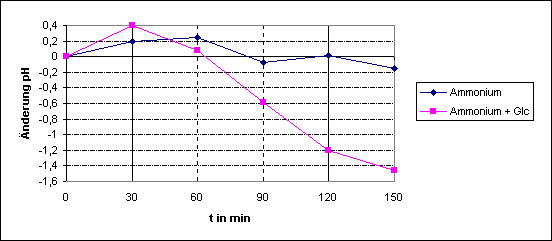
Gegen
die Erwartung steigt der pH-Wert erst einmal an. Eine mögliche Erklärung wäre,
dass die ausgehungerten Algen zuerst Chloridionen aufnehmen und folglich OH-
ins Medium abgeben.
Deutlich
ist zu sehen, dass die Aufnahme von Ammonium mit aktiven energieverbrauchenden
Prozessen gekoppelt ist. Der pH im Ansatz ohne Glucose fällt im betrachteten
Zeitraum so gut wie nicht ab, d.h. dass die Zellen fast kein Ammonium aufnehmen
können, da kein ATP mehr vorhanden ist. Im Ansatz mit Glucose hingegen fällt
der pH nach 1 h durch Abgabe von Protonen steil ab, woran man sehen kann, dass
Ammonium aufgenommen wurde.
Der
gleiche Versuchsansatz hätte noch mit KNO3 statt NH4Cl
durchgeführt werden sollen.
Dabei
wäre theoretisch zu erwarten gewesen, dass der pH-Wert durch Abgabe von OH-
ansteigt, da die Zellen Nitrat aufnehmen. Die Katalysatorwirkung der
Glucose hätte in etwa vergleichbar sein müssen.
_____________________________________________
Versuch
III C: Bestimmung der Gefrierpunktserniedrigung
Sind
in einem Lösungsmittel Stoffe gelöst, muss auf Grund der Wechselwirkungen mehr
Arbeit geleistet werden um die Stoffe aus dem Verband zu nehmen als bei reinem Lösungsmittel.
Die Folge ist eine Siedepunktserhöhung und Gefrierpunktserniedrigung, die nach
RAOULT proportional zur Molarität der Lösung ist. Für Wasser beträgt sie
1,86°C/mol.
Dies
macht man sich zu Nutze, um die Konzentrationen löslicher Substanzen
festzustellen.
Zur
Messung des Gefrierpunkts wurde ein Kryoskop verwendet. Mit Hilfe von Eis und
Kochsalz wurde eine sogenannte Kältemischung hergestellt, deren Temperatur -6°C
bis -7°C betragen sollte. Dabei musste darauf geachtet werden, dass der
Quecksilberfaden des Thermometers nicht abreißt.
Alle
Lösungen wurden erst auf -2°C abgekühlt und gerührt, bis die Temperatur
wegen der Schmelzwärme wieder anstieg. Das darauf folgende Maximum ist als der
Gefrierpunkt definiert.
Zunächst
wurde als Kontrolle die Gefrierpunktserniedrigung einer 0,5 M Saccharoselösung
bestimmt. Die Temperatur wurde etwa alle 20 sec in °C gemessen:
|
-0,10 |
-0,30 |
-0,59 |
-0,70 |
-0,90 |
-1,02 |
-1,10 |
-1,18 |
-1,20 |
0,30 |
Da
der Gefrierpunkt im positiven Bereich lag (0,3°C), muss ein Meßfehler
unterlaufen sein oder die Lösung war zu alt.
Theoretisch
müßte der Wert 0,5 x
1,86 = 0,93°C unter 0°C liegen.
Es
sollte nun die Molarität von Preßsaft einer temperiert gelagerten Kartoffel
gemessen werden und einer Kartoffel, die geringem Frost ausgesetzt war und
deshalb erhöhten Zuckergehalt aufweist.
Dazu
wurden wie oben das Maximum bzw. der Gefrierpunkt gemessen:
Temperiert
gelagerte Kartoffel:-0,6 °C
Frostkartoffel:
-1,8 °C
Berechnung
des Zuckergehalts:
Temperiert
gelagerte Kartoffel: 0,6/1,86 = 0,32 M
Frostkartoffel:
1,8/1,86 = 0,96 M
____________________________________________
Versuch 3: Transportprozesse, Wasserhaushalt II
A: Messung der Transpiration im Potometer
Durchführung
Die Saugkraft eines Stengels von Cyperus alternifolius wird in einem Potometer bei 3 verschiedenen Windgeschwindigkeiten untersucht.
Die Ausbreitungsgeschwindigkeit von Fuchsin in einem Blütenblatt einer Cyclame wird gemessen.
Ergebnisse
Die Tabelle zeigt die zurückgelegte Strecke der Luftblase am Potometer in cm
Luftfeuchtigkeit: 40-50%
Temperatur: 23 °C (Raumtemperatur)
|
Zeit in min. |
Ruhende Luft |
Wind, 5 m/sec |
Wind, 7 m/sec |
|
0 |
0 |
0 |
0 |
|
2 |
0,6 |
0,3 |
0,2 |
|
4 |
1 |
0,5 |
0,5 |
|
6 |
1,1 |
0,8 |
0,5 |
|
8 |
1,7 |
1,1 |
1,1 |
|
10 |
1,7 |
1,4 |
1,3 |
|
12 |
2,0 |
1,6 |
1,6 |
|
14 |
2,2 |
1,8 |
1,9 |
|
16 |
2,5 |
2,1 |
2,1 |
|
18 |
2,7 |
2,4 |
2,4 |
|
20 |
3,0 |
2,6 |
2,7 |
|
22 |
3,2 |
2,9 |
3,0 |
|
24 |
3,5 |
3,2 |
3,3 |
|
26 |
3,7 |
3,4 |
3,6 |
|
28 |
4,0 |
3,7 |
3,9 |
|
30 |
4,2 |
4,0 |
? |
Anhang 1 Zeigt die Werte in einem Diagramm.
Die Blüte zieht den Farbstoff 3 cm in 4 min hoch. Das ergibt eine Geschwindigkeit von
0,45 m/sec.
Diskussion
Der Wasserdampf, der sich in den Interzellularräumen befindet seht mit den Stomata in Verbindung. Sind die Schließzellen geöffnet kann der Wasserdampf nach Außen diffundieren, da dort seine Konzentration niedriger als in der Pflanze ist.
Die Bedingungen Außen beeinflussen die Diffusion maßgeblich. Bei windstillen Verhältnissen kann sich um die Stomata und auch um die anderen Organe der Pflanze ein Luftpolster bilden, in dem die Wasserdampfkonzentration höher ist als in der Umgebung. Es diffundiert relativ wenig Wasserdampf nach außen und die Pflanze sollte weniger Wasser ansaugen. Die Ergebnisse aus dem Versuch zeigen allerdings gegenteilige Ergebnisse. Dies könnte einerseits daran liegen, dass die Transportfunktion der Pflanze schon nicht mehr richtig funktionierte, andererseits an technisch bedingten Messfehlern, z.B. Luftblasen im Potometer oder ein Leck im Halteglas.
B: Selektive Ionenaufnahme
Durchführung
Zwei Testreihen einer Suspension von Chlorella werden angesetzt, eine mit Glucose die andere ohne. Die Algen waren zuvor einer Dunkelperiode ausgesetzt. Der Suspension wird NH4Cl oder KNO3 zugesetzt. Dann wird in regelmäßigen Abständen der pH-Wert gemessen. Durch die pH-Wert Änderung kann auf die bevorzugt aufgenommene Ionensorte geschlossen werden. Unsere Gruppe führte den Versuch mit NH4Cl durch.
Ergebnis
|
Zeit in min |
pH-Wert Probe I |
pH-Wert Probe II (mit Glucose) |
|
0 |
5,2 |
6 |
|
30 |
6,29 |
5,94 |
|
60 |
6,43 |
5,80 |
|
90 |
6,48 |
5,68 |
|
120 |
6,52 |
5,46 |
|
180 |
6,59 |
5,87 |
Anlage 1 zeigt die Daten in der graphischen Darstellung
Diskussion
Die beiden Proben verhalten sich gegenläufig, dh. Bei Probe I steigt der pH-Wert, während er bei Probe II sinkt. Dies entspricht nicht dem erwarteten Ergebnis. Da die Algen durch die Dunkelperiode „ausgehungert“ sind, sollten sie bevorzugt NH4+ aufnehmen, da Stickstoff ein wichtiger Wachstumsfaktor ist. Der pH-Wert sollte also sinken, und zwar bei der Probe mit Glucose schneller als bei der Probe ohne. Offensichtlich war die Zelle aber so sehr geschwächt, dass ohne Zugabe von Glucose zum Zeitpunkt der ersten Messung überhaupt kein aktiver Transport mehr stattfand. (Zwischen Proben-Ansatz und erster Messung lagen ca. 30 min., da die Eichung des pH-Meters etwas langwierig war) Der pH-Wert Anstieg bei Probe I ist damit zu erklären, dass die viel kleineren Cl--Ionen dem Konzentrationsgefälle fogend ins Zellinnere diffundiert sind, und zum Ausgleich Hydroxid-Ionen hinaus gelangten. Der letzte Wert bei Probe II zeigt ebenfalls einen Anstieg des pH-Wertes, möglicherweise war in der Probe zu diesem Zeitpunkt bereits alle Glucose aufgebraucht, so dass der gleiche Effekt wie bei Probe I eintrat.
C: Bestimmung der Gefrierpunktserniedrigung
Durchführung
In einem Kolben wurde mit Kochsalz und Eis eine Kältemischung hergestellt. Entgegen der Angaben im Skript mussten ca. 250 g NaCl zugegeben werden, um die Temperatur auf –6°C bis –7°C zu senken.
Um das Thermometer zu eichen, wird zuerst destilliertes Wasser in das Innengefäß gegeben. Der Gefrierpunkt lässt sich daran erkennen, dass die Temperatur kurz ansteigt um dann endgültig abzufallen. Allerdings geht dieser Vorgang sehr schnell und ist relativ schwer festzustellen. Der Gefrierpunkt sollte bei dest. Wasser bei 0°C liegen.
Mit dem so geeichten Thermometer bestimmen wir zunächst den Gefrierpunkt einer 0,3 molaren Saccharose-Lösung. Anschließend den von Kartoffelpressaft von gefrorenen Kartoffeln und nicht gefrorenen Kartoffeln.
Ergebnis
Die Tabelle zeigt die gemessenen Temperaturen der verschiedenen Proben in °C.
|
Zeit in Sek. |
Kartoffeln gefroren I |
Kartoffeln gefroren II |
Kartoffeln frisch I |
Kartoffeln frisch II |
Saccharose 0,3 mol/l I |
Saccharose 0,3 mol/l II |
Destilliertes Wasser |
|
10 |
-0,1 |
-0,5 |
-0,65 |
-0,75 |
-0,6 |
-0,6 |
0 |
|
20 |
-0,3 |
-1,0 |
-1,2 |
-1,13 |
-1,02 |
-1,22 |
0,10 |
|
30 |
-0,65 |
-1,45 |
-1,75 |
-1,6 |
-1,4 |
-1,8 |
0,12 |
|
40 |
-1,1 |
-1,9 |
-2,2 |
-2,0 |
-1,6 |
-2,0 |
-0,2 |
|
50 |
-1,5 |
-2,0 |
-1,5 |
-1,4 |
-2,0 |
-2,1 |
-0,35 |
|
60 |
-1,9 |
-1,8 |
-1,7 |
-1,35 |
-1,6 |
-2,5 |
-0,55 |
|
70 |
-1,8 |
-1,7 |
-2,2 |
-1,6 |
-1,05 |
-2,7 |
-0,9 |
|
80 |
-1,7 |
-1,6 |
-2,4 |
-1,8 |
-0,85 |
-2,95 |
-1,25 |
|
90 |
-1,8 |
-1,56 |
-2,55 |
-1,95 |
-0,78 |
-2,4 |
-1,65 |
|
100 |
-1,9 |
-1,6 |
-2,8 |
-2,2 |
-0,76 |
-1,1 |
-1,99 |
|
110 |
-2,1 |
-1,9 |
-3,12 |
-2,5 |
-0,8 |
-0,9 |
|
|
120 |
-2,5 |
-2,2 |
|
-2,8 |
-0,9 |
-0,8 |
|
|
130 |
-2,8 |
-2,6 |
|
|
-0,92 |
-0,7 |
|
|
140 |
-3,0 |
-2,9 |
|
|
-0,95 |
-0,76 |
|
|
|
|
|
|
|
|
-0,79 |
|
|
|
|
|
|
|
|
-0,84 |
|
|
|
|
|
|
|
|
-0,91 |
|
|
|
|
|
|
|
|
-0,97 |
|
Damit ergeben sich die folgenden durchschnittlichen Gefrierpunkte:
- Wasser dest: +0,1°C
- Saccharose 0,3 mol/l: -0,73°C (-0,83)
- Kartoffeln frisch: -1,43°C (-1,53)
- Kartoffeln gefroren: -1,63°C (-1,73)
Bei einer Gefrierpunktserniedrigung von 1,86°C/mol (nach Raoult) ergeben sich aus den um 0,1°C korrigierten Werten folgende Zuckerkonzentrationen
- Kartoffeln frisch: 0,8 mol/l (-0,83/1,86)
- Kartoffeln gefroren: 0,9 mol/l
Diskussion
Die Gefrierpunkterniedrigung nach Raoult beträgt 1,86°C/mol. Demnach müsste der Gefrierpunkt von 0,3 mol Saccharose bei 0,56°C liegen. Entweder war die Konzentration der Lösung zu hoch, oder der Wert wurde fehlerhaft abgelesen, jedenfalls liegt er bei uns um 0,83°C zu tief, da die Werte aufgrund der Eichung mit Wasser um 0,1°C nach oben korrigiert werden müssen.
Wie zu erwarten ist die Zuckerkonzentration in angefrorenen Kartoffeln höher, da durch den Frost Stärkedepots zerstört und abgebaut werden, und somit mehr Zucker freigesetzt wird.
Insgesamt erwies sich der Versuch als schwierig und die Meßwerte relativ ungenau, da die Kältemischung ziemlich oft zu warm wurde, und mit neuem Eis und Salz versehen werden mußte, was die Messung erschwerte.