Pflanzenphysiologisches
Praktikum Teil 1
Versuch
II, A: Messung der Saugkraft von Kartoffelparenchym
Die
Saugkraft einer Pflanzenzelle kann durch die Gleichung S = O - (W + A)
beschrieben werden. Sie hängt ab vom osmotischen Wert ihres Zellinhalts, von
der elastischen Spannung ihrer Wand und vom Außendruck.
Da
die Saugkraft von Lösungen dem osmotischen Wert entspicht, kann die Saugkraft
lebender Zellen durch eine Kompensationsmethode festgestellt werden.
Aus
einer Kartoffel wurden Quader bestimmter Größe geschnitten und zum Schutz vor
Verdunstung in einer feuchten Kammer aufbewahrt. Je 2 g davon wurden dann in 10
ml Saccharoselösung verschiedener Konzentrationen bzw. demin. Wasser eingelegt
und ab und zu geschüttelt.
Die
Lösungen wurden aus 0,5 M Stammlösung hergestellt:
0,4
M: 8 ml Stammlösung + 2 ml Wasser
0,3
M: 6 ml Stammlösung + 4 ml Wasser
0,2
M: 4 ml Stammlösung + 6 ml Wasser
0,1
M: 2 ml Stammlösung + 8 ml Wasser
Nach
2 h wurden die Stückchen mit Filterpapier ohne Druck abgetrocknet und gewogen.
|
Lösungen |
Anfangsgewicht
[g] |
Endgewicht
[g] |
Änderung
[g] |
|
0,5
M |
2,0 |
1,66 |
-0,34 |
|
0,4
M |
2,0 |
1,77 |
-0,23 |
|
0,3
M |
2,0 |
1,80 |
-0,20 |
|
0,2
M |
2,0 |
1,99 |
-0,01 |
|
0,1
M |
2,0 |
1,70 |
-0,30 |
|
demin.
Wasser |
2,0 |
2,40 |
+0,40 |
|
|
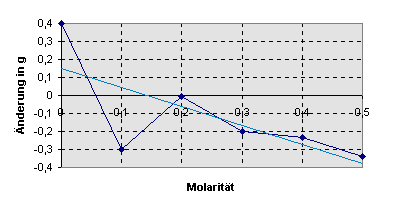
Diejenige
Konzentration, bei der weder Wasser aufgenommen noch abgegeben wird, d.h. keine
Gewichtsveränderung auftritt, entspräche theoretisch der Saugkraft des
Kartoffelparenchyms.
Die
eingefügte rosa Trendlinie schneidet die Abszisse bei 0,15 mol/l.
Da
jedoch die Gewichtsänderung in der 0,1 M Lösung als falsch angesehen werden
muss, erhält man ohne Berücksichtigung dieses Werts eine höhere Konzentration
von ca. 0,2 mol/l. Eventuell wurde die fehlerhafte Probe nicht sofort in die
feuchte Kammer gelegt, so dass das Kartoffelstückchen vor dem Wiegen ein wenig
ausgetrocknet war oder die Saccharoselösung war in diesem Fall fälschlicherweise
zu hoch konzentriert hergestellt worden.
Läßt
man den falschen Wert außen vor, zeichnet sich im Diagramm dennoch eine Gerade
ab, die eine Saufkraft des Kartoffelparenchyms von ca. 0,2 mol/l erwarten lässt.
Versuch II B: Einfluss des pH-Wertes auf die Quellung von Proteinen (Isoelektrischer
Punkt)
Aminosäuren
können je nach pH-Wert als Kation, Zwitterion oder Anion vorliegen und werden
daher auch Ampholyte genannt.
Proteine
quellen je nach pH verschieden stark. Am isoelektrischen Punkt (IEP) ist die
Affinität zum Wasser relativ gering, so dass hier schon geringer Wasserentzug
zur Ausflockung führt.
Titriert
man nun gequollene Proteinlösung mit Alkohol, so ist der Verbrauch am IEP am
niedrigsten, da die Hydratation schneller ein gewisses Maß unterschritten hat.
Gelatine
wurde in demin. heißem Wasser gelöst und in Acetat-Puffer-Lösungen
verschiedener pH-Werte gebracht (siehe Skript). Die Proben wurden bei 35°C
unmittelbar bis zur Titration gelagert.
Die
erste Probe wurde mit 96%igem Ethanol titriert, bis eine gerade erkennbare weiße
Trübung Ausflockung anzeigte. Die Trübung wurde mittels eines Photometers bei
blaugefiltertem Licht (500 nm) gemessen und die folgenden Proben bis zur etwa
gleichen Extinktion titriert, um vergleichbare Verbrauchswerte zu bekommen. Die
Meßreihe wurde doppelt ausgeführt.
|
|
1.
Meßreihe |
2.
Meßreihe |
|
|||
|
pH |
Verbrauch
EtOH in ml |
Extinktion |
Verbrauch
EtOH in ml |
Extinktion |
Mittelwert
EtOH- Verbrauch in ml |
|
|
3,8 |
26,2 |
0,258 |
30 |
0,233 |
28,3 |
|
|
4,2 |
27,6 |
0,291 |
29,5 |
0,306 |
28,55 |
|
|
4,7 |
27 |
0,551 |
26 |
0,332 |
26,5 |
|
|
5,2 |
26,8 |
0,211 |
27,6 |
0,287 |
27,2 |
|
|
5,6 |
28,7 |
0,356 |
28 |
0,295 |
28,35 |
|
|
6,2 |
29 |
0,310 |
28,7 |
0,305 |
28,85 |
|
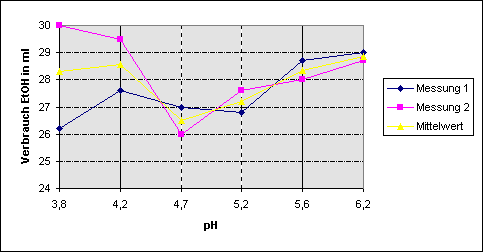
Da
die Extinktion sehr schnell ansteigt, war es nicht einfach, immer bis zu einem
bestimmten Wert zu titrieren. Z.B. wurde bei pH 4,7 in der 1. Meßreihe viel zu
weit titriert, so dass in diesem Falle die Mittelwertbildung problematisch ist.
Es ist jedoch abzusehen, dass man auch hier wie in der 2. Messung bei pH 4,7 den
niedrigsten Verbrauch gehabt hätte, wäre nicht zu weit titriert worden. Trotz
diesem „Ausreißer“ zeigt sich also, dass etwa bei pH 4,7 die Menge des
Hydratationswassers am geringsten ist und deshalb der IEP dort liegt.
Für
eine genauere Bestimmung des IEP müßte jedoch die pH-Staffelung um das Minimum
der Kurve enger sein, da nur dann der Scheitelpunkt annähernd bestimmt werden
kann.
Versuch
II C: Einfluss von Ionen auf die Permeabilität
Lebende
Zellen können viele Stoffe entweder aktiv aufnehmen oder durch Permeation in
einem Zellkompartiment anreichern. Der Vitalfarbstoff Methylenblau z.B. wird in
der Vakuole durch chemische Bindung akkumuliert. Die Permeabilität der
Membranen kann durch Ionen beeinflußt werden.
In
diesem Versuch sollte der Einfluß von Calcium- und Kaliumionen untersucht
werden, die wahrscheinlich für den Quellungsgrad der Membran mitverantwortlich
sind.
Es
wurden drei Lösungen hergestellt mit jeweils 40 ml 0,001%igem Methylenblau und
10 ml demin. Wasser, 0,1 mol/l KCl oder 0,1 mol/l CaCl2. Je 0,5 g
Sprossen von Elodea spec. wurden in
die Gläser gelegt und umgerührt.
Die
Extinktion bei 670 nm sollte im Abstand von 30 min gemessen werden ( erste
Messung erfolgte erst nach 10 min):
|
t |
Wasser |
KCl |
CaCl2 |
|
10
min |
1,052 |
0,780 |
0,864 |
|
30
min |
0,567 |
0,599 |
0,741 |
|
60
min |
0,439 |
0,477 |
0,646 |
|
90
min |
0,286 |
0,421 |
(0,712) |
Bei
dem in Klammern gesetzten Wert handelt es sich um einen Meßfehler, der
eventuell auf einer unsauberen Küvette oder einer Luftblase beruht.
Die
Aufnahme des Farbstoffs zeigte sich in einer Abnahme der Extinktion. Zur
Veranschaulichung der Intensitätsabnahme des Farbstoffs wurde der Betrag der
Abnahme errechnet:
|
t |
Wasser |
KCl |
CaCl2 |
|
10
min |
0 |
0 |
0 |
|
30
min |
0,485 |
0,181 |
0,123 |
|
60
min |
0,613 |
0,303 |
0,218 |
|
90
min |
0,766 |
0,359 |
(0,152) |
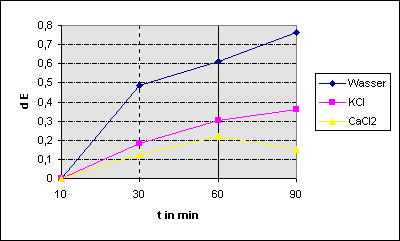
Eindeutig
zu erkennen ist, dass die Extinktion im Wasseransatz viel schneller zunahm als
in den Ionenansätzen. D.h. dass dort der Farbstoff am schnellsten aufgenommen
wurde; Kaliumionen setzten die Permeabilität herab und Calciumionen sogar noch
mehr, so dass Methylblau nur noch langsam aufgenommen wurde.
Auffällig
ist auch, dass beim Kaliumansatz die Kurve in einen Sättigungsbereich übergeht,
der wahrscheinlich auch beim Kaliumansatz zu erkennen wäre. Auf Grund des Meßfehlers
lassen sich aber keine eindeutigen Aussagen dazu machen. Von einer wirklichen Sättigung
auf Grund der Farbstoffkonzentration kann man hier jedoch nicht sprechen, da die
Zellen noch aufnahmefähig sind, wie im Wasseransatz zu sehen ist. Dort nimmt
die Extinktion noch relativ kontinuierlich zu. Es ist daher anzunehmen, dass die
„Sättigung“ auf die zunehmende Quellung der Membran durch die Ionen zurückzuführen
ist, die dadurch mit der Zeit impermeabel wird.