Versuch 1: Analytik
Pflanzenphysiologisches
Praktikum Teil I
Versuch
I A: Bestimmung des Trockengewichts
Das
Trockengewicht von Pflanzen wird bestimmt, indem man das Wasser abdampft.Dies
sollte möglichst rasch geschehen, um Verluste durch Abgabe anderer flüchtiger
Stoffe zu vermeiden.
5
g Lorbeerblätter wurden abgewogen und für 24 Std. bei 105°C in den
Trockenschrank gestellt. Das Leergewicht der Schale wurde zuvor bestimmt. Der
Versuch wird doppelt angesetzt. Nachdem die Proben im Eksikkator abgekühlt
waren, wurden sie ernneut gewogen.
|
Frischgewicht
in g |
Petrischale
leer in g |
Schlußwägung
in g |
Trockengewicht
in g |
Trockengewicht
in % |
|
5,0
|
89,5 |
92,8 |
3,3 |
66 |
1,7
g gingen demnach bei der Trocknung durch Verdunstung verloren, wovon der größte
Teil sicherlich Wasser war, aber auch in geringem Maße flüchtige Stoffe wie
z.B. ätherische Öle oder Ammoniak. D.h. dass Lorbeerblätter annähernd aus
44% Wasser bestehen, was ein relativ niedriger Wert ist.
Versuch
I B: Bestimmung des Gesamtstickstoffs nach Kjeldahl
Eine
Methode zur Abschätzung der Plasmamenge bietet die Bestimmung des
Gesamtstickstoffs. Sie ist sinnvoll, wenn man Gewebe unterschiedlicher Struktur
vergleichen will, da hier die Angabe des Trockengewichts oft nicht aussagekräftig
genug ist.
1. Aufschluß
Der
Aufschluß wurde mit zwei Parallelproben durchgeführt. Dazu wurden je 500 mg
Lorbeerblätter mit Kupfersulfat, Natriumsulfat und konz. Schwefelsäure in
Aufschlußkolben erhitzt. Nach 1 h wurde wenig Perhydrol zur Beschleunigung
zugesetzt. Nach 2 h war der Aufschluß bläulich und klar.
2. Destillation
Der
Stickstoff in Form von Ammoniak wurde durch die Zugabe von NaOH freigesetzt und
mittels der Wasserdampfdestillation (siehe Skript) in eine Vorlage getrieben,
die aus 20 ml 0,02 N HCl und Mischindikator besteht. NH3
neutralisierte dabei die Säure teilweise.
3. Titration
Die
nicht neutralisierte Säure wurde mit 0,02 N NaOH titriert.
Da
NaOH nicht titerstabil ist, mußte durch Titration ein Korrekturwert ermittelt
werden. Um 20 ml HCl zu neutralisieren, brauchten wir 20,3 ml HaOH. Daraus
ergibt sich der Korrekturwert von 20/20,3 = 0,99.
Bei
der ersten Probe wurde 17,4 ml NaOH verbraucht. Unter Einbezug des
Korrekturfaktors ergibt sich ein Wert von 17,14 ml NaOH.
Daraus
lässt sich die im Aufschluß vorhandene Menge an Ammoniak errechnen:
20
ml - 17,14 ml = 2,86 ml NH3.
Die
zweite Probe wurde nicht zu Ende titriert, da nach 50 ml NaOH noch kein
Farbumschlag zu erkennen war und demnach ein Fehler unterlaufen sein mußte.
Mit
Hilfe der chemischen Gleichung wurde der Stickstoffgehalt der Probe ermittelt:
m
(N)/ M (NH3) x 2,86/2 = 1,17 mg N2
Multipliziert
man diesen Wert mit dem empirischen Faktor 6, so erhält man annähernd den
Eiweißgehalt der Probe: 1,17 x 6 = 7,07 mg Eiweiß
|
mg
N2 in 0,5g Blätter |
mg
N2 in 5g Blätter |
N2-Gehalt
in % vom Trockengewicht |
|
1,17 |
11,7 |
0,35 |
Der
Stickstoffgehalt in Lorbeerblättern beträgt 0,35% des Trockengewichts.
---------------- 2. Beispiel ausführlich ------
VHCl
: 20ml = Volumen der eingesetzten 0,02 normalen HCl
VNaOH : 11 ml = Verbrauch der
0,02 normalen NaOH
VDelta : VHCl
- VNaOH = 20ml -
11 ml = 9 ml = 0.009 l
Differenz (=verbrauchte HCl)
c: Conc. der NaOH =
0,02 mol/l
M: Molare Masse des Stickstoffes N =14 g/mol
f:
Korrekturfaktor = 1,05
__________
Chemische Formeln:
c = n/V; n= m/M ;
wobei n = Zahl der Mole einer Lösung in mol
m = Masse des Stoffes in
g (hier: ein Atom Stickstoff)
c = conc.
V = Vol
==> m = c * M * V * f ;
==> m = 0,02 mol/l * 14 g/mol * 0,009 l * 1,05 = 2,6 mg
2,6 * 6 = 15,9 mg Protein
_______________
Versuch
I C: Bestimmung des Eisengehaltes in Rohasche
Durch
Aschenanalysen kann festgestellt werden, wieviel von jedem Element eine
Pflanze dem Boden entzieht. Dies ist z.B. für die Beurteilung des Düngerbedarfs
von Nutzen.
Ziel
des Versuches ist die quantitative Bestimmung von Eisen mittels der Photometrie.
1. Aufstellen
einer Eichkurve
Zuerst
wurden verschiedene Volumina einer Eisenlösung (1 ml = 0,1 mg Fe) in einen 25
ml-Kolben pipettiert, zu denen jeweils Salzsäure, Natriumacetatlösung,
Phenanthrolinlösung, Hydrochinonlösung und bis zur Marke Wasser gegeben
wurden. Nach 10 min wurde im Spektralphotometer bei 520 nm gegen Wasser
gemessen.
|
Volumen
Fe-Lsg. |
m
(Fe) in 25 ml |
Extinktion
bei 520 nm |
|
0 |
0,00 |
0,023 |
|
0,1 |
0,01 |
0,151 |
|
0,3 |
0,03 |
0,238 |
|
0,6 |
0,06 |
0,317 |
|
0,9 |
0,09 |
0,343 |
|
1,2 |
0,12 |
0,116 |
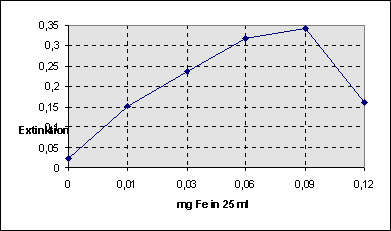
Abgesehen
davon, dass der letzte Wert wohl fehlerhaft ist, geht die Kurve ab ca. 0,06 mg
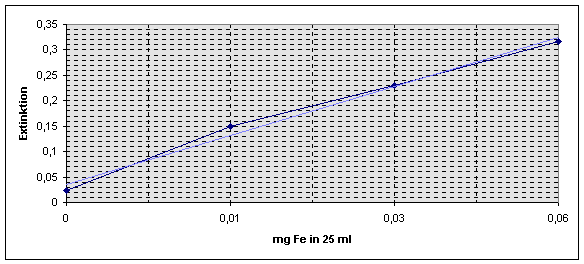
in eine Sättigungskurve über. Relevanter Ausschnitt der Kurve mit Eichgerade:
2.
Bestimmung des Eisengehaltes in der Asche
500
g der Rohasche von Lorbeer wurde in 10 ml 3 N HCl 15 min gekocht. Dann wurde die
Probe in einen 50 ml-Kolben filtriert, und je zweimal 1, 2 und 4 ml in 25ml
Kolben gegeben und mit den bereits bei der Eichkurve beschriebenen Reagenzien
versetzt.
|
|
1
ml Ansatz |
2
ml Ansatz |
4
ml Ansatz |
|||
|
Extinktion |
0,048 |
0,032 |
0,075 |
0,064 |
0,161 |
0,116 |
|
m
(Fe) in 25ml Kolben |
1,3
µg |
0
µg |
4
µg |
2,8
µg |
13
µg |
9
µg |
|
m
(Fe) in 50ml Kolben |
65
µg |
0
µg |
100
µg |
70
µg |
162,5
µg |
112,5
µg |
|
m
(Fe)/mg Asche |
0,13
µg |
0
µg |
0,2
µg |
0,14
µg |
0,33
µg |
0,23
µg |
|
Mittelwert/mg
Asche |
0,065
µg |
0,17
µg |
0,28
µg |
|||
Aus
diesen drei Ansätzen liesse sich ein Mittelwert von 0,17 µg/mg Asche
berechnen. Doch ist die Mittelwertbildung in diesem Fall problematisch, da die
Ansätze allein schon durch die Verwendung verschiedener Pipetten nicht unter
vergleichbaren Bedingungen durchgeführt wurden. Auch die graphische Ermittlung
der Eisenwerte aus der Eichgerade ist nicht sehr exakt, was sich dann
hochgerechnet in einer beträchtlichen Differenz der Mittelwerte manifestiert.
___________________________________________________________________
Versuch
V C: Keimungshemmung durch das Fruchtfleisch
Keimungshemmende
Stoffe („Blastokoline“) verhindern bei fleischigen Früchten das Keimen des
Samens innerhalb der Frucht. In einigen Fällen könnte es sich dabei eventuell
um Abszisinsäure handeln.
In
drei Petrischalen mit saugfähigem Papier wurden jeweils 15 Samen der
Gartenkresse (Lepidum sativum) gelegt
und mit 4 ml der in der Tabelle angegebenen Lösungen getränkt. In einer
vierten Schale wurden die Samen auf einer Apfelscheibe aufgebracht. Nach 2 Tagen
wurden die Samen im Kühlschrank konserviert um dem Schimmelwachstum vorzubeugen
und nach drei Wochen auf Keimung untersucht:
|
demin.
Wasser |
Äpfelsäure
(5mg/ml) |
Abszisinsäure (10-5 mol/l) |
Apfelscheibe |
|
+ |
- |
- |
- |
Dass
im Ansatz mit Wasser alle Samen gekeimt waren zeigt, dass die Samen keimfähig
sind und Keimungshemmung auf anderen Einflüssen beruht.
Da
auf der Apfelscheibe keine Keimung erfolgte, müssen darin hemmende Substanzen
sein. Möglicherweise ist dafür die Abszisinsäure verantwortlich, die die
Keimung supprimierte. Ob die Äpfelsäure auch hemmende Wirkung hat, läßt sich
mit diesem Versuchsansatz nicht feststellen, da zuerst überprüft werden müsste,
ob die Konzentration der verwendeten Äpfelsäurelösung der im Apfel
entspricht.