Übung Physiologie der Pflanzenernährung: Abbildungen

Versuch zur Transpiration

DC-Chromatographie

Auftrennung der Farbstoffe in der Trennkammer: A Einstellen der Kieselfolie mit der aufgetragenen Pigmentmischung in die Trennkammer mit dem Laufmittel. B Kieselfolie in der Kammer nach bereits erfolgter Auftrennung. C Kieselfolie mit Farbstoff-Banden.
Saugkraft von Kartoffel-Parenchym: „Feuchte Kammer“

HILL-Reagenz Dichlorphenolindophenol (DCPIP) kann Elektronen nach dem Photosystem II aufnehmen. Dabei wird das Reagenz entfärbt.
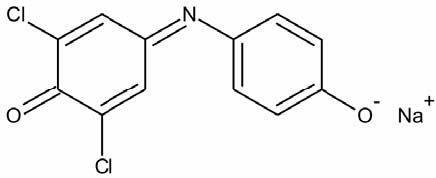
DCPIP
HiLL-Versuch

Hill-Reaktion: A Zellaufschluss durch Mörsern, B Abfiltrieren über Nylontuch, C Kochen der Thylakoidsuspension im Wasserbad.

immer wenn man mit Zellen arbeitet (so wie hier), alles kühlen!

Nach dem Sieben wird das Filtrat zentrifugiert Im Niederschlag finden sich die Chloroplasten


Messung der Extinktion: A Spektralphotometer, B Eppis mit den Ansätzen
in der Zentrifuge.
AUXIN-Versuch mit Koleoptilen:
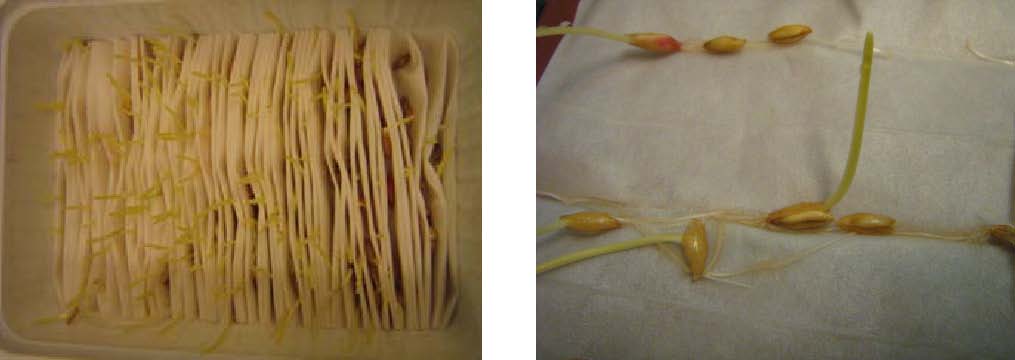
Die Anzuchtschale Die Keimlinge
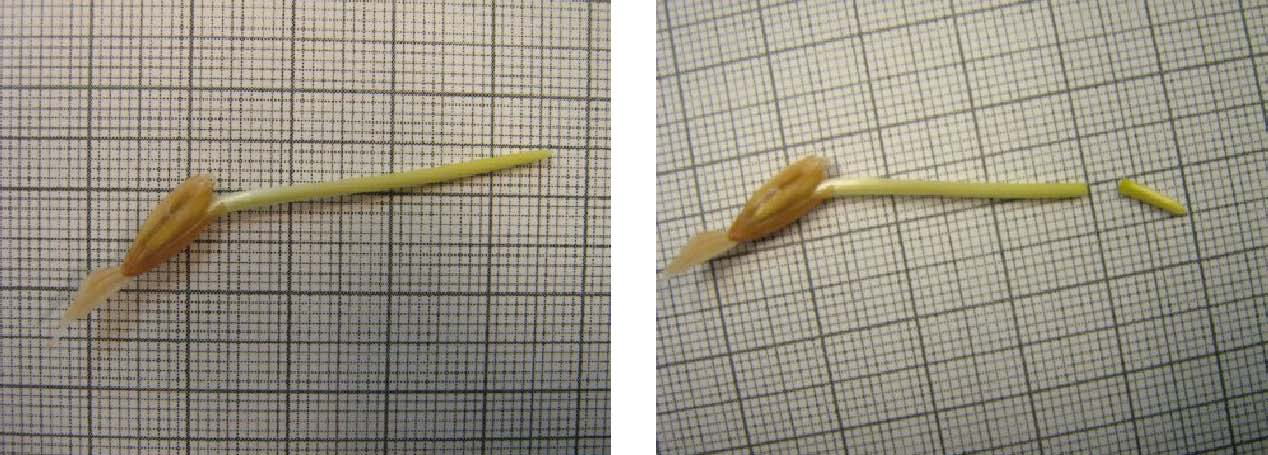

Messung nach 5 Std.
KJELDAHL N2

DER
NÄHRSTOFF-MANGEL-VERSUCH

Nährlösungskultur im Gewächshaus: A Beginn der Hydrokultur, kurz nach dem Versetzen in die Kulturgefäße, B 6 Wochen nach Versuchsbeginn.

N-Mangel Mais (links voll-ernährt, rechts Mangel)
N-Mangel bei Spinat: Ebenfalls Aufhellungen und Notblüte => Pflanze versucht sich mit ihren letzten Reserven noch fortzupflanzen und so das Weiterbestehen zu sichern.

N-Mangel bei Spinat
Phosphor-Mangel Mais:
 Phosphor-Mangel
Mais
Phosphor-Mangel
MaisK-Mangel: Kalium wird zum Aufrechterhalten des Turgordruckes benötigt. Blattränder sind daher als erstes betroffen und werden nekros, da aufgrund des geringen Turgordrucks, ähnlich wie bei Trockenstress, da Wasser leichter bzw. schneller verdunsten kann.

3 x K-Mangel
bei Mais
Magnesium-Mangel:
Mg-Mangel bei Mais: Mg-Typisch: Perlschnur-artige Aufhellungen, Chlorosen Æ nekrotisch Perlschnurartig angeordnete Läsionen und Chlorosen Magnesium hat eine wichtige Funktion als Bestandteil des Chlorophylls. Mg-Mangel führt zu lokalem Zelltod, was man auch Apotose nennt. Chlorosen entstehen, wenn in der Zelle Chlorophyll abgebaut wird.

Mg-Mangel

Die
Mg-Mangelpflanzen (Bild oben) zeigen beim Mais perlschnurartige
Läsionen
Ca-Mangel
Hierbei kam es zum Absterben des Apikalmeristems, da das Ca eine sehr wesentliche Bedeutung für das Wachstum der meristematischen Gewebe hat. Im Vergleich zur Zellteilung erfordert die Zellstreckung etwa eine 100fach höhere Ca-Konzentration. Es ist daher kein Zufall, daß Ca-Mangel die Ausbildung von Wurzelhaaren verhindert bzw. zu Nekrosen in der meristematischen Zone der Wurzeln und Blätter ( = unteres Blattdrittel ) führt. Außerdem spielt das Ca eine wichtige Rolle bei der Stabilisierung der Zellwände.
 <>2 x Ca-Mangel
Mais (Bild oben) <>
<>2 x Ca-Mangel
Mais (Bild oben) <>S-Mangel
Aufhellungen von innen her, d.h. von der Blattbasis. Der S ist ein wichtiges Bau- und Strukturelement der Pflanze. Viele Enzyme und Coenzyme enthalten Schwefel in Form funktioneller SH-Gruppen, die für den Ablauf der Enzymkatalyse unbedingt notwenig sind. S-Mangelsymptome sind den N-Mangelerscheinungen sehr ähnlich, zum Unterschied zu diesen treten sie aber an den jüngeren Blättern zuerst auf, in Form von Chlorosen ( hellgrün, hellgelb, teils auch rötlich ) mit fortschreitender Hemmung des Sproßwachstums. Da das Chlorophyll keinen Schwefel enthält, muß die S-Mangelchlorose offenbar indirekt, d.h. über eine Beeinträchtigung der Proteinsynthese, durch Mangel an S-haltigen Aminosäuren, ursächlich bedingt sein.

S-Mangel
bei Spinat (Bild
oben)
Mn-Mangel:
Symptome
vorwiegend lokalisiert , auf jüngeren und mittleren Blättern Dörfleckenkrankheit.:

Mn Mangel (Bild oben)
Cu-Mangel:

Zink Mangel: typisches Zinkmangelsymptom ist ein gestauchter Wuchs (Zwergwuchs), da Zink wichtig für die Zellteilung ist. Bei Zinkmangel sinkt der Chlorophyllgehalt der Pflanzen ab, wodurch Chlorrosen bis zur Weißfärbung des Blattes eintreten können. Die Löslichkeit von Zink geht mit steigendem pH-Wert und bei sehr hohen Phosphatgehalten im Boden zurück. Zinkmangel kann daher auf neutralen bis alkalischen, carbonatreichen Böden, oder nach einer Kalkung auftreten.

2 x Zink-Mangel (Bild oben)
Fe-Mangel:
Die unteren, d.h. die älteren Blätter sind besser versorgt, was für die
geringe Beweglichkeit des Eisens in der Pflanze spricht. Eisen wird
bevorzugt in der zweiwertigen Form aufgenommen, und muss daher vor der
Aufnahme reduziert werden => Die Frage einer ausreichenden
Versorgung hängt daher sehr wesentlich ab von der Fähigkeit der
Pflanzenwurzel, Eisen zu reduzieren. Die Verlagerung in der Pflanze
erfolgt dann als Fe3+-Citrat, da aber für den pflanzlichen Stoffwechsel
allein Fe2+ physiologisch relevant ist, muss Fe3+ wieder vom Komplex
abgespalten und in den Blättern erneut reduziert werden. Dieser Vorgang
ist lichtabhängig ( 420nm ). Hinsichtlich Aufnahme und Transport
konkurriert Fe2+ mit anderen 2-wertigen Metallen, vor allem Ca2+.
Fe-Mangel wird daher durch ein hohes Ca-Angebot noch verschärft. 
Bor-Mangel:
Der Transport ist an den Transpirationsstrom des Xylems gebunden, daher gibt es keine sekundären Umlagerungen und die Mangelsymptome sind auf die jüngeren Pflanzenteile konzentriert. Borsäure bildet stabile Mono- und Diester mit cis-Diolen (versch. Zucker und ihre Derivate). Die Phosphogluconsäure bildet einen stabilen Boratkomplex der in weiterer Folge die Bildung von Cellulose und Pektine regelt. Ein anderer Weg führt zur Bildung von Lignin. Beides führt zu einer Stabilisierung der Zellwände. Wichtig ist weiters die Beteiligung an der Uracil-Bildung (RNA-Bestandteil) wodurch bei Mangel der Sprossvegetationspukt abstirbt. An den Blättern bilden sich oft Chlorosen aus, bei Beta- und Kohlrüben kommt es zur Herz- und Trockenfäule.

Bor – Toxizität (streifenförmige Nekrosen Am Blattrand)

Optional: AUXIN-Versuch im
Gewächshaus:
mit IES befüllte Auxin-Eppendorf –Hütchen werden auf die dekaptierten
Feuerbohnen-pflanzen aufgesteckt: 
GEWEBEKULTUR:

Protoplasten-Regeneration
auf
Netzen

Protoplasten-Isolation: Cellulase- und Pektinase-Verdau

Proto-Filtration,
-Protoplasten-Iso Protoplasten
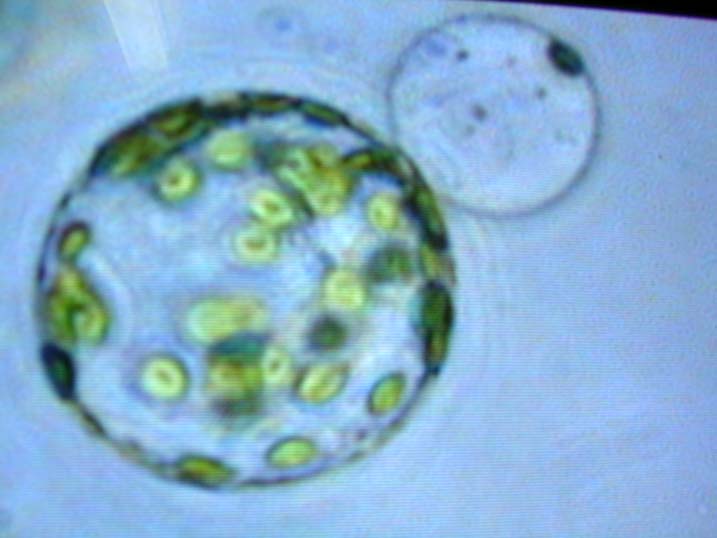
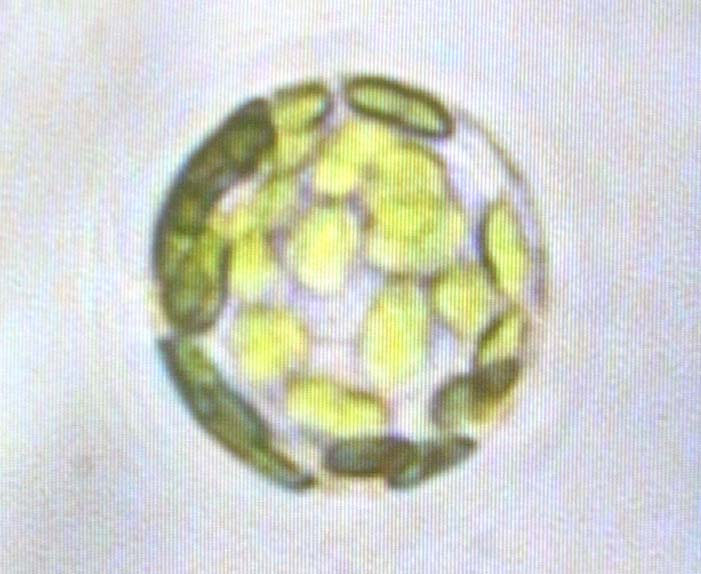
Isolierter Protoplast